|
研究テーマ ○侵害受容器TRPチャネルの分子解析 Transient
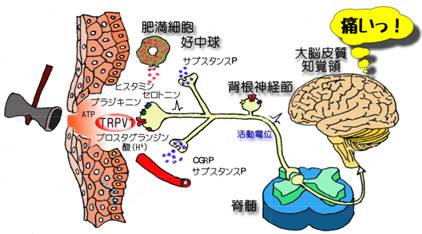
Receptor Potential(TRP)チャネルは,ショウジョウバエの光感受性変異の原因因子となるイオンチャネルとして発見されました。現在では様々なタイプ(TRPV、TRPA、TRPM、TRPC、TRPML、TRPP)が同定され,スーパーファミリーを形成しています。これらのチャネルはそれぞれに機能的な特徴を示すとても興味深い分子です。 TRPバニロイド(vanilloid)1(TRPV1)チャネルはトウガラシの辛味成分であるカプサイシン(capsaicin)の受容体として知られていますが、熱や酸に対しても感知する部位がある非選択的な陽イオンチャネルです。TRPV1は末梢の知覚神経に発現し、侵害受容器としてカプサイシンのような刺激性の化学物質および熱や酸を痛みとして認識する機能を有しています。これまで、TRPV1を活性化させる様々な化合物を見出し(Ohta et al., 2007, 2009)、また炎症時に体内で作られる物質(炎症性メディエーター)によりTRPV1の機能が亢進することを明らかにしています(Ohta et al., 2006,2010)
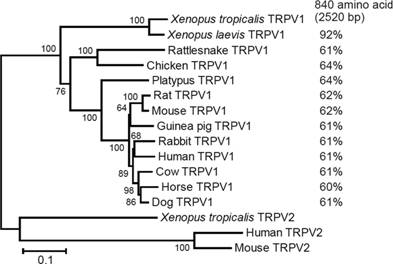
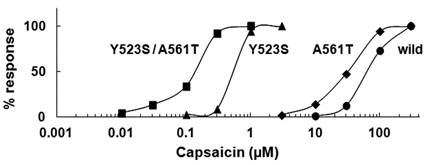
◆炎症性メディエーターによるTRPV1チャネルの感作(Ohta et al., 2006, 2010) 研究室では両生類のTRPV1チャネルの機能解析を行っています。アフリカツメガエル(X.tropicalis)のTRPV1チャネルはヒトTRPV1チャネルよりもカプサイシンに対する感受性が1000倍も弱いことを発見し,分子生物学的手法によってその差異が2ヶ所のアミノ酸によって引き起こされていることを明らかにしました(Ohkita et al. 2012)。
また,知覚神経にはTRP ankyrin
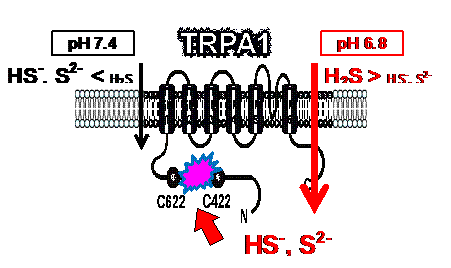
1(TRPA1)チャネルも発現し、TRPV1と合わせて痛みを認識するセンサーとして機能しています。TRPA1は、ワサビの辛味成分であるイソチオシアン酸アリル(allyl isothiocyanate)を受容するチャネルとして知られています。TRPA1はこの辛味成分だけでなく、シナモンやショウガなどに含まれる天然の香気成分も受容します。また、過酸化水素やホルマリン、排気ガス成分のアクロレインなどの刺激性のある環境化学物質などもTRPA1を活性化します。 これらに加えて、研究室では呼吸器疾患の原因物質であるカドミウムや火山ガスの有毒成分である硫化水素がTRPA1を活性化し、痛みの要因となることおよびその分子生物学的メカニズムについて明らかにしました(Ogawa et al.
2012, Miura et al. 2013, Takahashi and Ohta 2013)。硫化水素は生体内でも産生され、その生理学的な役割について注目が集まっています。炎症組織はしばしば酸性状態となり、炎症組織で硫化水素が産生されるとTRPA1の活性化を介した痛みの発生が強まることと、そのメカニズムについても研究室では明らかにしました。
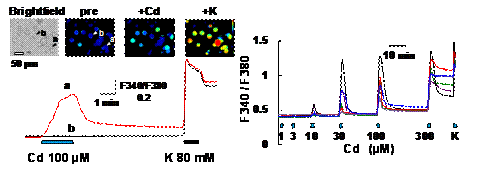
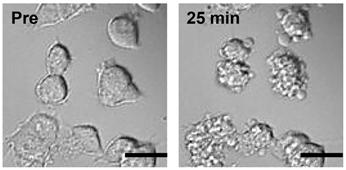
図3 カドミウムによる知覚神経細胞の活性化(Miura et al.
2013)
図4 硫化水素(H2S)によるTRPA1チャネルの活性化(Ogawa et al.
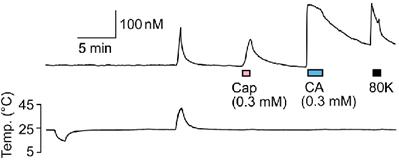
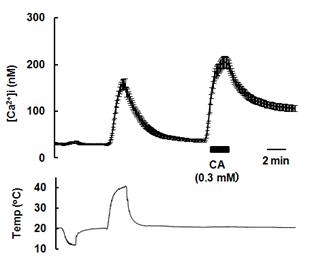
2012, Takahashi and Ohta 2013) 更には、このTRPA1はこれまで冷温(17℃〜)を感知することが報告されているものの議論の最中で、温度センサーとしての役割については未解明な状態です。研究室では、は虫類や両生類のTRPA1が冷温ではなく、熱(グリーンアノール[34℃]、アフリカツメガエル [40℃])を感知することを解明し、TRPA1が進化の過程でその役割を変化させている可能性があることを証明しました(Saito et al. 2012)。
図5 アフリカツメガエル(X.tropicalis)TRPA1の温度感受性(Saito et al.
2012) そして、ほ乳類と同じく外気温の変化で体温が変化しない(恒温動物)の鳥類TRPA1についてもその機能を調べ、ニワトリTRPA1が熱センサーとして働くことも見出しました(Saito et al.
2014)。
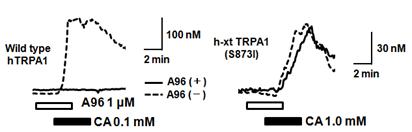
また、鎮痛薬開発の上でTRPA1のアンタゴニストの発見は重要になりますが、これまで用いられているTRPA1のアンタゴニストはほ乳類ではその作用が認められるものの、両生類ではアンタゴニストとして作用しないことを発見し、動物種によるTRPA1チャネルの分子構造に差異があることも明らかにしています(Nakatsuka et
al. 2013)。
現在も、様々な動物種によるTRPV1やTRPA1の役割の違いを探索し、これらの分子の進化過程を明らかにすることに興味を持って進めています。また、これらのチャネルが受容する新しい物質の探索とその情報を基盤とした鎮痛薬の開発を目指しています。 これらの研究は、TRPチャネル研究の第一人者である自然科学機構生理学研究所の富永真琴教授との共同研究によって進められています。
|
|||||||||||||||
|
○2-Aminodiphenyl borate(2-APB)の新しい薬理作用とその応用 2-APBは主な薬理作用として、細胞内のCa2+ストアに存在するIP3受容体の遮断作用があり、細胞内のCa2+シグナルを解析する上で広く用いられている化合物です。また、TRPチャネルの解析が進むに従って、現在ではTRPチャネル(TRPV1、TRPV2、TRPV3、TRPA1など)を活性化することが分かり、これらのアゴニストとしても使用されています。 研究室では、酸性環境下の細胞に対して2-APBが著しいCa2+流入を引き起こし、その結果細胞死に至ることを見出しました(Takahashi and
Ohta 2012)。更には、酸性条件での2-APBの一時的な刺激は神経細胞様PC12細胞の細胞内Ca2+濃度を増加させ、神経分泌作用を促進することを明らかにしました。このメカニズムを詳細に解析すると細胞内Ca2+ストアが枯渇したときに活性化するOraiチャネルに作用する可能性が分かりました。OraiチャネルにはOrai1、Orai2、Orai3が存在し、siRNAによる各分子のノックダウンを行ったところ、酸性条件下で2-APBはOrai3に作用してCa2+流入を引き起こすことを明らかにしました。2-APBは中性条件でOrai3に作用することはこれまでにも他のグループによって示されてきましたが、2-APBがプロトンと協調してOrai3に作用するという新しい可能性が示されました。これらの結果は、腫瘍組織が生体のpHに比べて酸性になることから2-APBは腫瘍組織に対してのみ細胞死を引き起こすことが可能となり、新しい制がん方法の開発につながります。 図8 酸性環境(pH 6.5)における2-APBの細胞死誘発(Takahashi and
Ohta 2012)
|
|||||||||||||||
|
平成25年度より本学農学部附属菌類きのこ遺伝資源センターの一員としてきのこに含まれる成分の新しい役割の探索を実施しています。きのこにはこれまで毒性成分の薬理作用の発見や免疫を活性化させることによる抗がん作用などが知られています。しかし、これまでに同定された世界中の菌類きのこは実際に存在する中のごくわずかといわれ、未だ発見に至らない品種は数万種におよぶとされています。そのため、それらの新しく発見された品種を含め、多くの菌類きのこの成分の有用な生体機能については未解明のままです。
研究室では、これまでのTRPチャネルの解析成果や細胞分子生物学の解析手法を用いて、菌類きのこ成分のこれまでに明らかにされてない新しい薬理作用の同定とその応用開発を進めています。 |