研究内容
生体制御化学研究室では、細胞の機能を制御(コントロール)する『生体制御分子』を『創る・探す・役立てる』という研究を行っています。現在は、主に以下の三つの研究テーマを軸としています。
1.ポリヒスチジンペプチドを利用した薬物輸送技術の開発研究
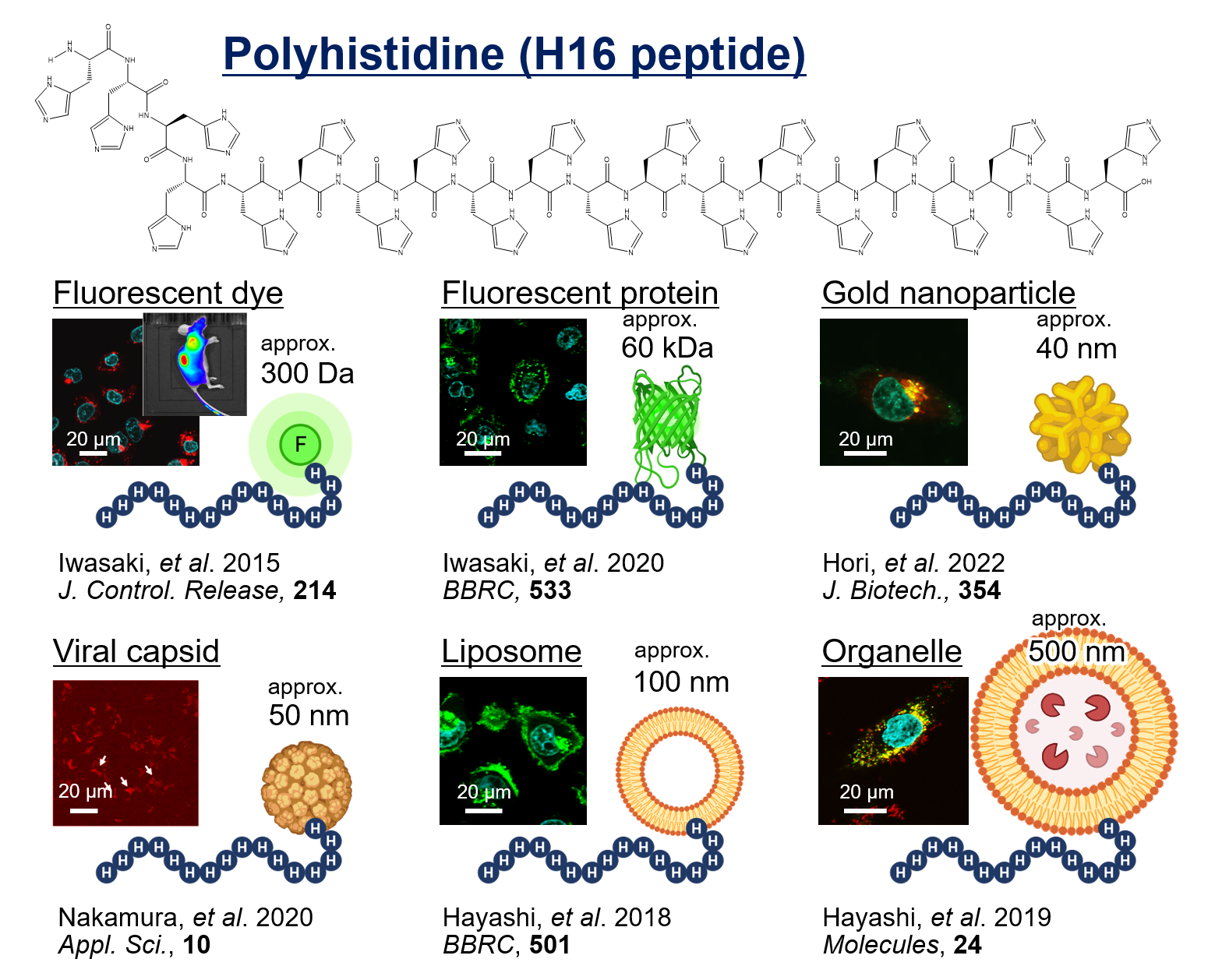
生きものを構成する細胞の中に、薬を送り届ける技術をドラッグデリバリーシステム(DDS)と呼びます。我々の研究室で発見された新しい細胞膜透過ペプチド『ポリヒスチジンペプチド』は、細胞膜を通り抜けて、効率的に細胞の中に入ることができることから、薬の新しい運び屋としてDDSへの応用が期待されています。
これまでの研究から、ヒト細胞に対しては、ポリヒスチジンのヒスチジン残基数が多くなるほど細胞膜透過能が上昇し、ヒスチジン16残基以上のポリヒスチジンペプチド(H16ペプチド)が、特に腫瘍細胞に対して高い細胞膜透過能を示すことが分かりました(特許第6202707号)。さらに製薬会社との共同研究では、腫瘍(繊維肉腫)を人工的に形成させた担癌マウスの体内において、ポリヒスチジンペプチド(H16ペプチド)は正確にがん組織に集積することが分かりました(Iwasaki
et al. 2015, J. Control. Release, 214)。
さらに、これまでの研究より、ポリヒスチジンペプチド(H16ペプチド)は蛍光色素のような低分子から、タンパク質、金ナノ粒子、ウイルスキャプシドのような高分子、さらにはリポソームやリソソームといった大きな膜小胞まで、幅広いサイズの物質を効率的に細胞内へ輸送する能力を有していることが分かりました(Hayashi
et al. 2018, BBRC, 501; Hayashi et al. 2019, Molecules, 24; Iwasaki et al. 2020, BBRC, 533; Nakamura et al. 2020, Appl. Sci., 10)。これらの研究成果から、ポリヒスチジンペプチド(H16ペプチド)は極めて魅力的なDDS素材であると言えます。現在はさらに研究を進めることで、鳥取大学発の新しい薬物輸送技術を創り出していくことを目指しています。
関連情報
■ 鳥取大学広報誌『風紋』51号 鳥大発・薬の新しい運び屋『ポリヒスチジン』
■ プレスリリース 薬剤の輸送を助ける新しい細胞膜透過ペプチドの発見
■ Peptide Newsletter Japan No.104 新しい細胞膜透過ペプチド『ポリヒスチジンペプチド』
■ Peptide Newsletter Japan No.124 ポリヒスチジンペプチドを利用したリソソーム標的型 DDS
■ 特許第6202707号
■ Iwasaki et al. 2015, J. Control. Release, 214
■ Hayashi et al. 2018, BBRC, 501
■ Hayashi et al. 2019, Molecules, 24
■ Iwasaki et al. 2020, BBRC, 533
■ Nakamura et al. 2020, Appl. Sci., 10
■ Hori et al. 2022, J. Biotech., 354
2.ポリヒスチジンペプチドを利用した植物機能改変技術の開発研究
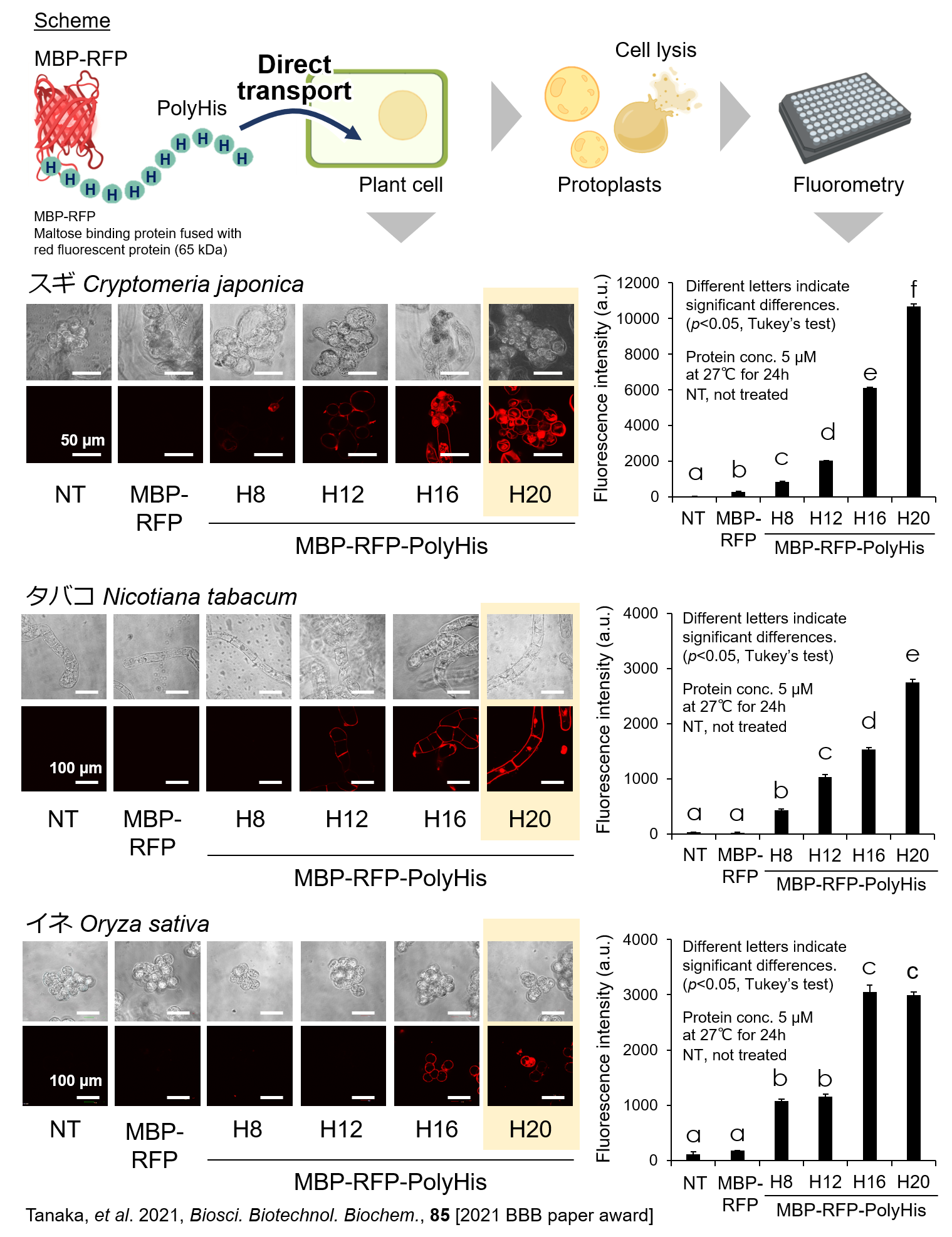
植物細胞は細胞壁と細胞膜を有しており、さらに細胞壁は高密度な負電荷を帯びています。ゆえに、細胞壁と細胞膜が強固な物理的・化学的なバリアーとなるため、植物細胞内にペプチド・タンパク質や核酸のような極性分子(親水性化合物)が入ることは難しいとされています。しかしながら、これまでの我々の研究より、ポリヒスチジンペプチドは細胞壁と細胞膜を透過し、植物細胞の中に移行できることが明らかになりました(Kimura et al. 2017, Biosci. Biotechnol. Biochem., 81)。
さらに、タンパク質や核酸といった本来は植物細胞に入ることができない化合物についても、ヒスチジン20残基以上のポリヒスチジンペプチド(H20ペプチド)を利用することで、植物細胞内へ簡便に導入できることが分かりました(Tanaka
et al. 2021, Biosci. Biotechnol. Biochem., 85)。ポリヒスチジンペプチド(H20ペプチド)の植物細胞に対する高い分子輸送能を応用することで、植物細胞内へ簡便に核酸を導入してタンパク質を発現させる技術(特許第6961202号)や、遺伝子組換えを使わないゲノム編集技術(国際出願PCT/JP2021/046845)を開発しました。現在は、これらの技術をさらに改良しつつ、農業をはじめとした様々な産業分野で役に立つ技術の創出を目指しています。
関連情報
■ Kimura et al. 2017, Biosci. Biotechnol. Biochem., 81
■ Tanaka et al. 2021, Biosci. Biotechnol. Biochem., 85 [2021年 B.B.B.論文賞]
■ 特許第6961202号
■ より短時間での植物品種改良が可能になる、ゲノム編集酵素遺伝子の挿入が不要なゲノム編集技術の開発
■ 国際出願PCT/JP2021/046845
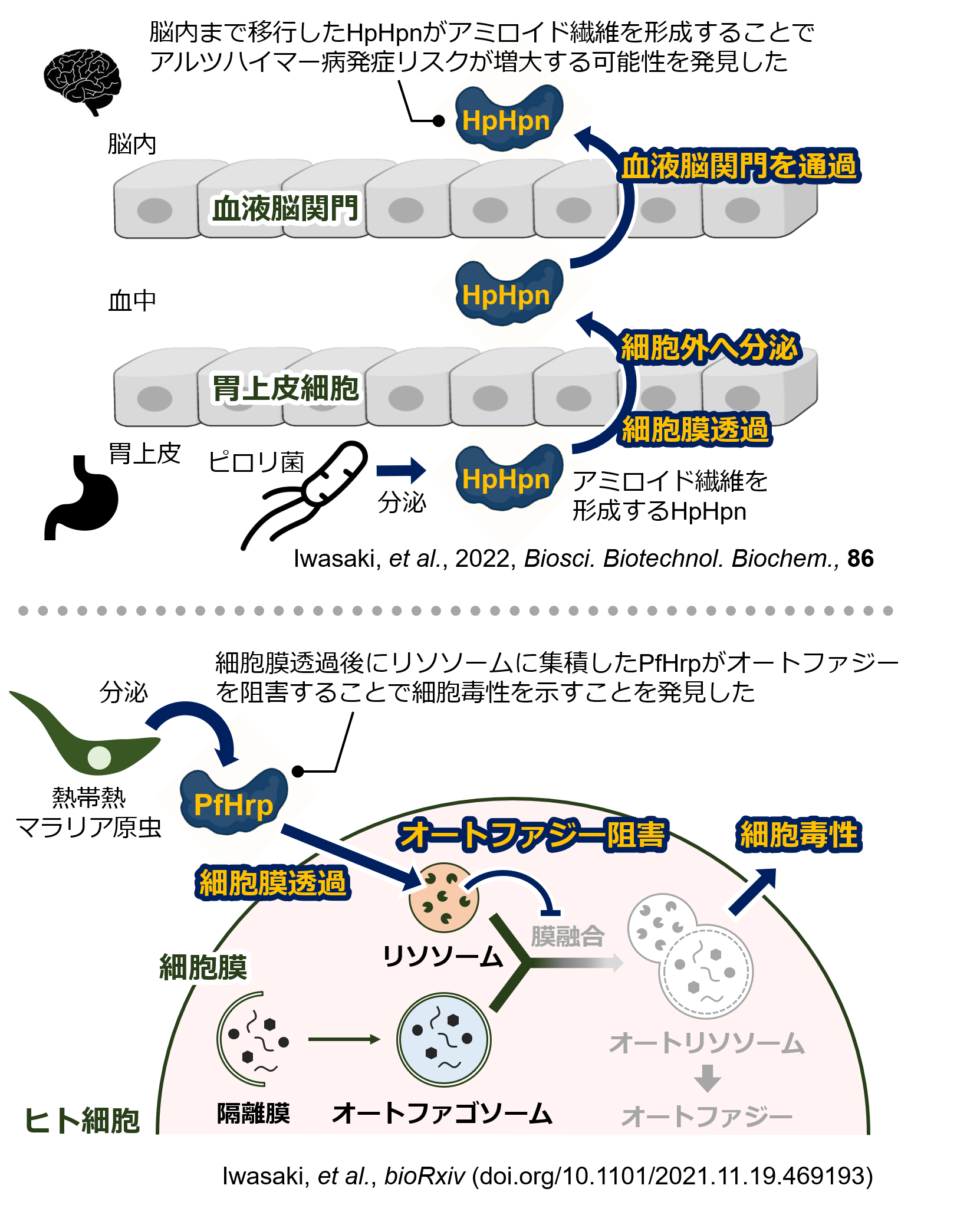
3.ヒスチジンリッチな生体制御分子の探索研究
これまでに我々の研究室では、人工的に合成したヒスチジンリッチなペプチド(ポリヒスチジンペプチド)や、ポリヒスチジンペプチドを融合したヒスチジンリッチなタンパク質が高い細胞膜透過を示すことを明らかにしてきました。これらの研究成果より、「自然界に存在する天然のヒスチジンリッチペプチドやタンパク質についても、同様に細胞膜透過をするのではないか?」との仮説に至りました。この仮説を調べるため、現在は様々な「天然ヒスチジンリッチペプチド・タンパク質」について、細胞膜透過と生理機能の解明に挑戦しています。
大変興味深いことに、現在までの研究により、ピロリ菌(Helicobacter pylori)のヒスチジンリッチペプチド(HpHpn)が、ヒト胃上皮細胞や血液脳関門を通過することが明らかになっています。ピロリ菌感染とアルツハイマー病発症は関連があると報告されており、またHpHpnはアミロイド様繊維を形成するためにアルツハイマー病の原因の一つではないかと考えられています。しかし、ピロリ菌は胃に存在する細菌であるため、胃の中で産生されたHpHpnが脳内まで到達するメカニズムはこれまで不明でした。我々の研究では、このHpHpnが胃上皮細胞と血液脳関門をそれぞれ透過することを明らかにすることで、HpHpnが胃から脳内へ移行するメカニズムの一端を解明できました(Iwasaki
et al. 2022, Biosci. Biotechnol. Biochem., 86)。
また、別の研究では、熱帯熱マラリア原虫(Plasmodium falciparum)のヒスチジンリッチタンパク質(PfHrp)も同様に、ヒト細胞に対して高い膜透過を示すことが分かりました。熱帯熱マラリア原虫がヒトに感染すると、PfHrpが血中に多量に放出されることが知られています。そのため、PfHrpは熱帯熱マラリアの感染マーカーとして診断に使われています。しかしながら非常に興味深いことに、我々の研究では、PfHrpは様々なヒト細胞内へ透過した後に、細胞毒性を示すことが明らかになりました。この現象は、PfHrpは熱帯熱マラリアの単なる感染マーカーではなく、病原性因子であることを示しています(Iwasaki
et al. 2021, bioRxiv)。
このように、「天然ヒスチジンリッチペプチド・タンパク質」はヒトの健康と関連する新しい生体制御分子であることが分かってきました。現在はさらに様々なヒスチジンリッチペプチド・タンパク質の研究を進めており、新しい生命現象の発見を目指しています。
関連情報
■ Iwasaki et al, 2022, Biosci. Biotechnol. Biochem., 86 [2022年 B.B.B.論文賞]
■ Iwasaki et al, 2021, bioRxiv